版权所有 Copyright(C)2012
一带一路国际合作联盟 机构成员目录
瑞典-中国技术转移中心; 新西兰-中国自贸协会;西班牙阿拉贡对外发展局; 阿根廷拉里奥哈省政府驻深圳代表处 ; 意大利-中国贸易发展促进会;冈比亚伊斯兰共和国驻中国商务代表处; 俄罗斯南部联邦经济促进会;瑞中企业家协会; 电气电子工程师学会(IEEE)深圳办公室; 比利时-卢森堡-非洲-加勒比海-太平洋国家商会; 瑞士瑞中投资促进协会;巴中协会深圳代表处;爱尔兰投资发展局;日本商工会;法国驻广州总领事馆商务处深圳联络处;布鲁塞尔外国投资与贸易促进局;中国哥伦比亚商会;巴中工商总会;法国罗纳-阿尔卑斯大区企业国际发展协会; 韩中经济贸易促进协会深圳代表处;法国工商总会;丹麦哥本哈根投资促进局;德国商会; 以色列驻华贸易代表处深圳联络处;欧盟商会;香港应用科技研究院;韩国商工会;加拿大高新技术产业协会;俄罗斯萨玛拉州工商会中国代表处;卢旺达投资与出口促进局中国代表处;匈牙利创新与技术中心;加拿大大西洋商会;中埃南方商务理事会;法国维埃纳省中国办事处;新加坡科技企业家俱乐部;以色列-中国技术转移中心;保加利亚普罗夫迪夫市驻深圳代表处;保加利亚中国商会;芬兰诺鼎联盟;芬兰政府投资促进署;芬兰圣纳约基市投资促进署 ;芬兰 VIEXPO 出口促进会 ;芬兰圣纳约基应用科技大学 ;芬兰商会劳马地区分会;芬兰商会西海岸分会 ;芬兰圣纳约基科技园 ;新西兰商业联合会;德中经贸合作总会;法国-深圳投资促进会;巴西工商总会;泰国国际商会;马来西亚雪兰莪皇室;泰国国际认证孵化中心;马来西亚一带一路总商会;新西兰商业联合协会;美国CEO俱乐部深圳代表处;中巴联合软件发展协会;中以高科技合作促进中心;中阿经济文化联合会;缅甸中央合作社;匈牙利创新与技术中心;泰王国驻广州领事馆;中国伊朗创新中心;马来西亚中国国际智库;东北亚国际商会联盟;中国国际贸促委深圳委员会;中国科学院云计算中心;深圳市质检会、粤港澳大湾区质量认证促进国际贸易专委会(排名不分先后)
未完,略
本站由 珠海耐思智慧 提供技术支持
备案号码: 粤ICP备09063828号  粤公网安备 44049002000123号
粤公网安备 44049002000123号
声明:本网站中所使用到的其他各种版权内容,包括但不限于文章、图片、视频、音频、字体等内容版权归原作者所有,如权利所有人发现,请及时告知,以便我们删除版权内容
消毒产品备案上市综述
时下消毒产品需求量大增,很多企业打算生产,并向联盟秘书长咨询,联盟多年来策划大量相关国际国内产品,具有丰富的相关经验,现将相关知识及程序公布,以伺读者。策划相关产品上市,欢迎具备实力和诚意的企业联系我们。附国家卫生健康委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知.
一、消毒产品定义
消毒产品包括:消毒剂、消毒器械(含生物指示物、化学指示物和(灭菌物品包装物)、卫生用品和一次性使用医疗用品。
根据《中华人民共和国传染病防治法》、《消毒管理办法》、《消毒产品标签说明书管理规范》、《消毒产品卫生安全评价规定》、《消毒技术规范》、《卫生行政许可管理办法》、《新消毒产品和新涉水产品卫生行政许可管理规定》的要求,在中国境内销售和生产的消毒类产品根据风险不同,实行分类管理。
二、消毒产品分类
按照消毒产品用途、使用对象的风险程度实行分类,具体如下:
第一类是具有较高风险,需要严格管理以保证安全、有效的消毒产品,包括用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械、皮肤黏膜消毒剂,生物指示物和灭菌效果化学指示物。
(注:高水平消毒剂:是指可杀灭一切细菌繁殖体、分枝杆菌、病毒、真菌及其孢子等,对致病性细菌芽孢也有一定的杀灭作用,达到高水平消毒要求的消毒剂。)
第二类是具有中度风险,需要加强管理以保证安全、有效的消毒产品,包括除第一类产品外的消毒剂、消毒器械,以及抗(抑)菌制剂。
(注:抗(抑)菌制剂:是指直接接触皮肤粘膜的、具有一定杀、抑菌作用的制剂(栓剂、皂剂除外)。抗菌制剂在使用剂量下,对检验项目规定试验菌的杀灭率≥90%(杀灭对数值≥1.0);抑菌制剂在使用剂量下,对检验项目规定试验菌的抑菌率≥50%。)
第三类是风险程度较低,实行常规管理可以保证安全、有效的除抗(抑)菌制剂外的卫生用品。
特殊情况:同一个消毒产品涉及不同类别时,应当以较高风险类别进行管理。
三、消毒产品审批和备案规定
(根据WTO非歧视性原则,对进口消毒产品的监管要求应等同于国产消毒产品)
新消毒产品包括:利用新材料、新工艺技术和新杀菌原理生产消毒剂和消毒器械。
2、需要获得备案凭证
第一和第二类消毒产品先做好安全评价报告,并向省卫生部门备案并取得
案凭证(各省执行会有差异)
四、备案要求及说明
备案要求:
第一类、第二类消毒产品首次上市时,产品责任单位应当将卫生安全评价报告向所在地省级卫生计生行政部门备案。省级卫生计生行政部门对卫生安全评价报告进行形式审查,资料齐全的应当在5个工作日内向产品责任单位出具备案凭证,并对备案的卫生安全评价报告加盖骑缝章。
评价内容:
卫生安全评价内容包括产品标签(铭牌)、说明书、检验报告(含结论)、企业标准或质量标准、国产产品生产企业卫生许可资质、进口产品生产国(地区)允许生产销售的批文情况。其中,消毒剂、生物指示物、化学指示物、带有灭菌标识的灭菌物品包装物、抗(抑)菌制剂还包括产品配方,消毒器械还应当包括产品主要元器件、结构图。
责任单位的卫生安全评价应当形成完整的《消毒产品卫生安全评价报告》,评价报告包括基本情况和评价资料两部分。
检验要求:
新的法规进一步完善和规范了检验项目,对送检样品、检验方法、检验结论等均提出了明确要求。
在对消毒产品进行卫生安全评价时,应当对消毒产品进行检验,并对样品的真实性负责。所有检验项目应当使用同一个批次产品完成(检验项目应符合要求)首次申请备案的,应做按规定检测,检验应当在具备相应条件的消毒产品检验机构进行。并且检测报告需要对产品符合性出具总的结论,检验机构应当符合消毒管理的有关规定,通过实验室资质认定,在批准的检验能力范围内从事消毒产品检验活动。(实验室不需要专门的授权)
对延续备案的,在对消毒产品进行检验时,只作关键项目。其中,消毒(灭菌)剂检验项目为有效成分含量、pH值和一项抗力最强的微生物杀灭试验,消毒(灭菌)器械检验项目为主要杀菌因子强度和一项抗力最强的微生物杀灭试验,生物指示物检验项目为含菌量的测定,灭菌化学指示物检验项目为颜色变化情况的测定。两年内国家监督抽检合格的检验项目可不再做。
有效期:
卫生安全评价报告在全国范围内有效。第一类消毒产品卫生安全评价报告有效期为四年,第二类消毒产品卫生安全评价报告长期有效。
第一类消毒产品卫生安全评价报告有效期满前,生产企业应当重新进行卫生安全评价和备案。
五、日常监督检查
对在华责任单位和国内生产企业,每年例行检查一次。
六、消毒产品备案流程简图
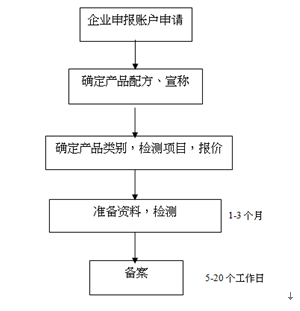
国家卫生计生委要求第一类、第二类消毒产品首次上市前需要自行或者委托第三方进行卫生安全评价,评价合格的消毒产品方可上市销售。
卫生安全评价项目包括:消毒剂检验项目、消毒器械检验项目、指示物检验项目、灭菌物品包装物检验项目、抗(抑)菌制剂检验项目。
主要含四个报告,分别是理化指标检验报告,是杀灭微生物效果检测报告、毒理学安全性检测报告和消毒检验规定要求提供的其他试验检验报告;
理化指标检验报告又包括有效成分含量测定报告、PH值测定报告、化学稳定性检测报告、金属腐蚀性检测报告、样品见误差检测报告和有毒杂志检测报告;
政府备案申报需要排队,周期太长,影响新品上市,本联盟指定的检测机构,为企业提供全程备案申报服务,强大技术支持加周期优势,为企业产品上市提供高效保障。
策划相关产品上市,欢迎具备实力和诚意的企业联系我们。有意者注明实名+事由添加微信WG19789568,或按本照网站注明的地址及联系方式联络我们。
国家卫生健康委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知
国卫办监督函﹝2020﹞99号
各省、自治区、直辖市及新疆生产建设兵团卫生健康委:
当前新型冠状病毒感染的肺炎疫情形势严峻,部分地区出现消毒剂供应紧张问题。为保障全国消毒剂的有效供给,现就有关事项通知如下:
一、紧急上市的醇类消毒剂在产品责任单位检测(或委托检测)含量合格后可上市销售使用,醇类手消毒剂醇类有效成分浓度>60%(V/V),其他乙醇消毒液原料应当符合GB26373-2010《乙醇消毒剂卫生要求》且乙醇含量为70%-80%(V/V)。
二、紧急上市的含氯消毒剂、二氧化氯消毒剂、过氧乙酸消毒剂,在产品责任单位检测(或委托检测)有效成分含量和pH符合相关卫生标准后,可上市销售使用。84消毒液有效期限定为3个月(有稳定性检测报告的除外)。
三、已备案上市的消毒剂,产品责任单位因扩大其生产规模而增加生产线、生产车间或生产地点的,在产品责任单位检测(或委托检测)消毒剂有效成分含量和pH符合相关卫生标准后,可上市销售使用。
上述紧急上市消毒剂的国内生产企业应当取得消毒产品生产企业卫生许可证。在产品上市销售前,应当及时向属地消毒产品备案部门提交消毒剂标签说明书和产品质量安全承诺书(附消毒剂有效成分含量和pH检测合格报告)。与已备案产品同类的进口消毒剂,在华责任单位向属地消毒产品备案部门提交产品质量安全承诺书(附国外产品上市证明文件和检验报告)后,可先行上市销售使用。
上述紧急上市消毒剂在上市销售使用的同时,产品责任单位应当按照WS628-2018《消毒产品卫生安全评价技术要求》的检验项目进行检测,并按规定进行备案。新型冠状病毒感染的肺炎疫情防控应急响应结束后,产品责任单位未完成检验和备案的,应当立即停止生产销售上述紧急上市消毒剂。有继续生产销售意愿的,应当按照原有正常程序办理相关手续,否则将按照《传染病防治法》、《消毒管理办法》等有关规定严肃查处。
国家卫生健康委办公厅
2020年2月3日



